HOME > 寄稿者一覧 > 上塚 芳郎 > 医療材料使い捨ての無駄を考える > 医療材料使い捨ての無駄を考える
医療材料使い捨ての無駄を考える
東京女子医科大学医学部
医療・病院管理学 上塚芳郎
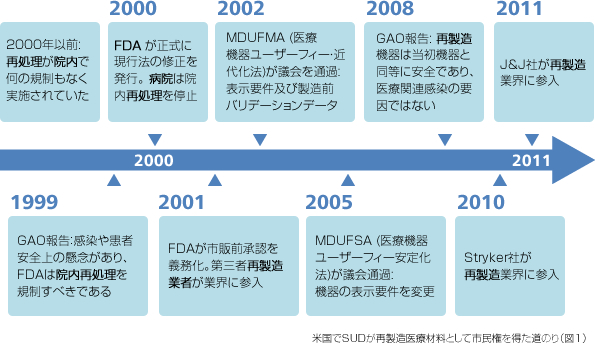
医療材料の中には、当然単回使用(single use device:SUD)で廃棄しなければならない材料も存在するが、製品の質の向上により再滅菌すれば複数回使用できるものも多く存在する。我が国では、感染のリスクから多くの医療材料の添付文書に単回使用廃棄(ディスポ)と書かれている製品が多いが、意外なことに米国では、SUDを消毒、性能の確認、再滅菌、パッケージングして販売しているのである。そしてそれは合法なのだ。
地球上がごみであふれる時代、資源の有効利用そして医療費の削減に、再滅菌(再製造)医療材料について解説する。
![]()
| A1(包括) | いずれかの診療報酬項目において包括的に評価されているもの (例:縫合糸、ガーゼ) |
| A2(特定包括) | 特定の診療報酬項目において包括的に評価されているもの(例:眼内レンズ) |
| B(個別評価) =特定保険医療材料 |
材料価格が個別に設定され評価されているもの (例:ペースメーカー、人工関節) |
| C1(新機能) | 新たな機能区分が必要で、技術はすでに評価されているもの |
| C2(新機能・新技術) | 新たな機能区分が必要で、技術が評価されていないもの |
| F | 保険適用になじまないもの |
<参考文献>